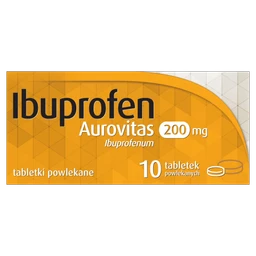
Jednoczesne stosowanie przeciwwskazane. Ze względu na ryzyko wydłużenia odstępu QT i torsades de pointes przeciwwskazane jest jednoczesne stosowanie flukonazolu z cyzaprydem, astemizolem, pimozydem, chinidyną, erytromycyną. Przeciwwskazane jest stosowanie flukonazolu podawanego w dawkach 400 mg lub większych z terfenadyną. Należy dokładnie kontrolować jednoczesne podawanie flukonazolu w dawkach mniejszych niż 400 mg/dobę z terfenadyną. Jednoczesne stosowanie niezalecane. Flukonazol może zwiększać stężenie halofantryny w osoczu z powodu hamującego działania na CYP3A4. Jednoczesne stosowanie flukonazolu i halofantryny może zwiększać ryzyko kardiotoksyczności (wydłużenie odstępu QT, torsade de pointes) oraz w rezultacie nagłej śmierci z przyczyn sercowych. Należy unikać stosowania tego skojarzenia. Jednoczesne stosowanie z ostrożnością. Podawanie flukonazolu jednocześnie z amiodaronem może doprowadzić do wydłużenia odstępu QT. Należy zachować szczególną ostrożność w przypadku, gdy jednoczesne stosowanie flukonazolu z amiodaronem jest konieczne, zwłaszcza dużych dawekh flukonazolu (800 mg). Jednoczesne stosowanie z ostrożnością oraz koniecznością modyfikacji dawki. Jednoczesne stosowanie flukonazolu i ryfampicyny powodowało zmniejszenie AUC flukonazolu o 25% i skrócenie T0,5 flukonazolu o 20%. Należy rozważyć możliwość zwiększenia dawki flukonazolu u pacjentów przyjmujących jednocześnie ryfampicynę. Badania interakcji wykazały, że doustne stosowanie flukonazolu wraz z pokarmem, cymetydyną, lekami zobojętniającymi kwas żołądkowy lub po napromieniowaniu całego ciała przed przeszczepieniem szpiku kostnego nie wpływa w sposób istotny klinicznie na wchłanianie flukonazolu. W badaniu dotyczącym interakcji farmakokinetycznych podanie wielu dawek hydrochlorotiazydu zdrowym ochotnikom przyjmującym flukonazol doprowadziło do wzrostu stężenia flukonazolu w osoczu o 40%. Efekt tego rzędu nie powinien wymagać konieczności modyfikacji dawki flukonazolu u pacjentów leczonych jednocześnie diuretykami. Wpływ flukonazolu na inne leki. Flukonazol jest umiarkowanym inhibitorem izoenzymów 2C9 i 3A4 cytochromu P450 (CYP). Flukonazol jest również silnym inhibitorem izoenzymu CYP2C19. Oprócz wymienionych poniżej, zaobserwowanych i potwierdzonych w badaniach interakcji, istnieje ryzyko występowania w osoczu podwyższonych stężeń innych leków metabolizowanych przez CYP2C9, CYP2C19 lub CYP3A4, stosowanych w skojarzeniu z flukonazolem. Należy zawsze zachować ostrożność podczas jednoczesnego stosowania tych leków, a pacjentów należy dokładnie obserwować. Wpływ flukonazolu hamujący aktywność enzymu może utrzymywać się przez 4 do 5 dni po zakończeniu leczenia, z powodu długiego okresu półtrwania flukonazolu. Flukonazol (inhibitor CYP2C19, 2C9, 3A4) zwiększał ekspozycję na cząsteczkę aktywną abrocytynibu o 155%. W przypadku jednoczesnego stosowania z flukonazolem należy dostosować dawkę abrocytynibu zgodnie z zaleceniami dla pacjenta dotyczącymi dawkowania abrocytynibu. W trakcie jednoczesnego stosowania u zdrowych ochotników flukonazolu (400 mg) oraz alfentanylu podawanego dożylnie (20 μg/kg mc.), AUC10 alfentanylu zwiększało się 2-krotnie, prawdopodobnie w wyniku hamowania CYP3A4. Konieczna może być modyfikacja dawki alfentanylu. Flukonazol nasila działanie amitryptyliny i nortryptyliny. Stężenie 5-nortryptyliny i (lub) S-amitryptyliny można oznaczyć na początku leczenia skojarzonego, a następnie po tygodniu. W razie konieczności należy zmodyfikować dawkowanie amitryptyliny i nortryptyliny. Jednoczesne podawanie flukonazolu i amfoterycyny B zakażonym myszom z prawidłową i osłabioną czynnością układu odpornościowego wykazało następujące wyniki: niewielkie addycyjne działanie przeciwgrzybicze w przypadku zakażenia ogólnoustrojowego przez C. albicans, brak interakcji w przypadku zakażenia wewnątrzczaszkowego przez Cryptococcus neoformans oraz antagonizm obu leków w przypadku zakażenia ogólnoustrojowego przez Aspergillus fumigatus. Kliniczne znaczenie wyników uzyskanych w tych badaniach jest nieznane. Po wprowadzeniu leku do obrotu notowano przypadki krwawień (siniaki, krwawienia z nosa, krwawienia z przewodu pokarmowego, krwiomocz i smoliste stolce) związane z wydłużeniem czasu protrombinowego u pacjentów otrzymujących jednocześnie flukonazol i warfarynę. W czasie jednoczesnego stosowania flukonazolu i warfaryny czas protrombinowy wydłużył się 2-krotnie, prawdopodobnie z uwagi na hamowanie metabolizmu warfaryny przez CYP2C9. U pacjentów przyjmujących jednocześnie pochodne kumaryny lub indanedionu i flukonazol należy kontrolować czas protrombinowy. Może być konieczne zmodyfikowanie dawki leku przeciwzakrzepowego. Po podaniu doustnym midazolamu flukonazol zwiększał stężenie midazolamu oraz nasilał wpływ leku na czynności psychomotoryczne. Jednoczesne stosowanie flukonazolu w dawce 200 mg oraz midazolamu podawanego doustnie w dawce 7,5 mg zwiększało AUC midazolamu oraz wydłużało okres półtrwania odpowiednio 3,7- i 2,2- krotnie. Flukonazol w dawce 200 mg na dobę stosowany jednocześnie z 0,25 mg podawanego doustnie triazolamu zwiększał odpowiednio AUC triazolamu oraz wydłużał okres półtrwana odpowiednio 4,4- oraz 2,3-krotnie. Podczas jednoczesnego podawania flukonazolu i triazolamu obserwowano nasilone oraz przedłużone działanie triazolamu. Jeśli konieczne jest jednoczesne stosowanie benzodiazepin i flukonazolu, zaleca się zmniejszenie dawek benzodiazepin oraz właściwe kontrolowanie pacjenta. Flukonazol hamuje metabolizm karbamazepiny i zwiększa stężenie karbamazepiny w surowicy o 30%. Istnieje ryzyko rozwoju toksyczności karbamazepiny. Może być konieczne dostosowanie dawkowania karbamazepiny w zależności od wyników pomiaru stężenia i (lub) od działania leku. Niektóre leki z grupy antagonistów wapnia (nifedypina, izradypina, amlodypina, werapamil i felodypina), są metabolizowane przez CYP3A4. Flukonazol może zwiększać ogólnoustrojowe narażenie na działanie antagonistów wapnia. Zaleca się częste kontrolowanie pacjenta pod względem występowania działań niepożądanych. Podczas jednoczesnego leczenia flukonazolem (200 mg na dobę) i celekoksybem (200 mg) Cmax i AUC celekoksybu zwiększały się odpowiednio o 68% i 134%. Podczas jednoczesnego stosowania z flukonazolem konieczne może być zmniejszenie dawki celekoksybu o połowę. Jednoczesne leczenie cyklofosfamidem i flukonazolem powoduje zwiększenie stężenia bilirubiny i kreatyniny w surowicy. Leki te mogą być stosowane jednocześnie, jeśli zostanie rozważone zwiększone ryzyko zwiększania stężenia bilirubiny oraz kreatyniny w surowicy. Zanotowano jeden przypadek śmiertelny zatrucia fentanylem, prawdopodobnie w wyniku interakcji fentanylu z flukonazolem. Ponadto wykazano, że u zdrowych ochotników flukonazol znacząco opóźnia eliminację fentanylu. Zwiększone stężenie fentanylu może prowadzić do wystąpienia depresji oddechowej. Należy ściśle kontrolować pacjenta ze względu na ryzyko związane z wystąpieniem depresji oddechowej. Może być konieczna zmiana dawkowania fentanylu. Ryzyko miopatii i rabdomiolizy zwiększa się (zaleznie od dawki) podczas jednoczesnego podawania flukonazolu z inhibitorami reduktazy HMG-CoA metabolizowanymi z udziałem CYP3A4, takimi jak atorwastatyna i symwastatyna, lub metabolizowanymi z udziałem CYP2C9, takimi jak fluwastatyna (zmniejszony metabolizm wątrobowy statyn). Jeśli leczenie skojarzone jest konieczne, należy obserwować, czy u pacjenta nie występują objawy miopatii i rabdomiolizy oraz kontrolować aktywność kinazy kreatynowej. Jeśli znacznie zwiększy się aktywność kinazy kreatynowej lub rozpozna się lub podejrzewa miopatię lub rabdomiolizę, należy przerwać stosowanie inhibitorów reduktazy HMG-CoA. Może być konieczne stosowanie mniejszych dawek inhibitorów reduktazy HMG-CoA, zgodnie z dostępnymi informacjami dotyczącymi przepisywania statyn. Umiarkowane inhibitory CYP3A4, takie jak flukonazol, zwiększają stężenie ibrutynibu w osoczu i mogą zwiększać ryzyko toksyczności. Jeśli nie można uniknąć skojarzonego stosowania, dawkę ibrutynibu należy zredukować do 280 mg raz na dobę (2 kaps.) przez okres stosowania inhibitora i ściśle monitorować stan kliniczny pacjenta. Jednoczesne stosowanie z iwakaftorem, substancją, która wzmacnia działanie białka CFTR, zwiększyło 3-krotnie ekspozycję na iwakaftor oraz 1,9-krotnie na hydroksymetyloiwakaftor (M1). Konieczne jest zmniejszenie dawki iwakaftoru (stosowanego w monoterapii lub w skojarzeniu), zgodnie z dostępnymi informacjami dotyczącymi przepisywania iwakaftoru (stosowanego w monoterapii lub w skojarzeniu). Umiarkowane inhibitory CYP3A4, np. flukonazol, zwiększają stężenie olaparybu w osoczu; nie zaleca się ich jednoczesnego stosowania. Jeśli nie można uniknąć skojarzonego stosowania tych produktów, dawkę olaparybu należy zmniejszyć do 200 mg 2 razy na dobę. Flukonazol znacząco zwiększa stężenie i AUC cyklosporyny. W czasie jednoczesnego leczenia flukonazolem w dawce 200 mg na dobę oraz cyklosporyną (2,7 mg/kg mc./dobę) obserwowano 1,8-krotne zwiększenie AUC cyklosporyny. Leki te można stosować jednocześnie, zmniejszając dawkę cyklosporyny w zależności od jej stężenia. Flukonazol może powodować zwiększenie stężenia ewerolimusu w osoczu poprzez inhibicję izoenzymu CYP3A4, chociaż nie przeprowadzono badań in vitro ani in vivo. Flukonazol zwiększa stężenie syrolimusu w osoczu, przypuszczalnie w wyniku hamowania jego metabolizmu z udziałem CYP3A4 i P-glikoproteiny. Leki te można stosować w skojarzeniu, jeśli dostosuje się dawkę syrolimusu w zależności od wartości stężenia i (lub) działania leku. Flukonazol może nawet 5-krotnie zwiększać stężenie w surowicy takrolimusu podawanego doustnie, z powodu hamowania jego metabolizmu przez CYP3A4 w jelitach. Nie zaobserwowano znaczących zmian parametrów farmakokinetycznych po dożylnym podaniu takrolimusu. Zwiększanie się stężenia takrolimusu wiązało się z nefrotoksycznością. Dawkowanie doustnie podawanego takrolimusu należy zmniejszyć w zależności od jego stężenia. Flukonazol hamuje metabolizm losartanu do czynnego metabolitu (E-31 74), który głównie warunkuje antagonizm w stosunku do receptora angiotensyny II, występujący podczas leczenia losartanem. U pacjenta należy stale kontrolować ciśnienie tętnicze krwi. Umiarkowane inhibitory CYP3A4, takie jak flukonazol, mogą zwiększać stężenie lurazydonu w osoczu. Jeśli nie można uniknąć jednoczesnego stosowania, należy zmniejszyć dawkę lurazydonu zgodnie z dostępnymi informacjami dotyczącymi przepisywania lurazydonu. Flukonazol może zwiększać stężenie metadonu w surowicy - konieczna może być modyfikacja dawki metadonu. Podczas jednoczesnego stosowania z flukonazolem, Cmax i AUC flurbiprofenu zwiększały się odpowiednio o 23% i 81% niż podczas podawania samego flurbiprofenu. Podobnie Cmax i AUC farmakologicznie czynnych izomerów [S-(+)-ibuprofen] zwiększyły się odpowiednio o 15% i 82%, kiedy flukonazol był podawany jednocześnie z racemiczną odmianą ibuprofenu (400 mg) w porównaniu do podawania samej racemicznej odmiany ibuprofenu. Chociaż brak specyficznych badań, flukonazol może zwiększać narażenie ogólnoustrojowe na inne NLPZ metabolizowane przez CYP2C9 (np. naproksen, lornoksykam, meloksykam, diklofenak). Zaleca się częste kontrolowanie występowania działań niepożądanych i objawów toksyczności, związanych ze stosowaniem NLPZ. Może być konieczna modyfikacja dawkowania niesteroidowych leków przeciwzapalnych. Flukonazol hamuje metabolizm wątrobowy fenytoiny. Podanie flukonazolu w dawce 200 mg jednocześnie z fenytoiną w dawce 250 mg, dożylnie zwiększało wartość AUC24 fenytoiny o 75% oraz wartość Cmin o 128%. Podczas jednoczesnego stosowania z fenytoiną należy monitorować jej stężenia w surowicy, w celu uniknięcia toksycznego działania fenytoiny. Zaobserwowano pojedynczy przypadek leczonego prednizonem pacjenta z przeszczepem wątroby, u którego wystąpiła ostra niewydolność kory nadnerczy po zaprzestaniu 3-miesięcznego leczenia flukonazolem. Odstawienie flukonazolu przypuszczalnie spowodowało nasilenie aktywności CYP3A4, co doprowadziło do zwiększonego metabolizmu prednizonu. U pacjentów długotrwale leczonych flukonazolem należy dokładnie kontrolować, czy po odstawieniu flukonazolu nie występują objawy niewydolności kory nadnerczy. Flukonazol zwiększa stężenie ryfabutyny w surowicy, prowadząc do zwiększenia AUC ryfabutyny nawet o 80%. Zanotowano zapalenia błony naczyniowej oka u pacjentów jednocześnie otrzymujących flukonazol i ryfabutynę. Podczas leczenia skojarzonego należy brać pod uwagę wystąpienie objawów toksyczności ryfabutyny. Flukonazol zwiększa AUC sakwinawiru o około 50% i Cmax o około 55% w wyniku hamowania metabolizmu wątrobowego sakwinawiru przez CYP3A4 oraz hamowania P-glikoproteiny. Interakcje z sakwinawirem i rytonawirem nie były badane i mogą być bardziej nasilone. Konieczna może być modyfikacja dawkowania sakwinawiru. U zdrowych ochotników flukonazol wydłuża okresy półtrwania w surowicy podawanych doustnie pochodnych sulfonylomocznika (chlorpropamidu, glibenklamidu, glipizydu i tolbutamidu). Podczas jednoczesnego stosowania zaleca się częste kontrolowanie stężenia glukozy we krwi oraz odpowiednie zmniejszenie dawki sulfonylomocznika. W kontrolowanym placebo badaniu interakcji, przyjmowanie flukonazolu w dawce 200 mg przez 14 dni powodowało zmniejszenie średniego klirensu osoczowego teofiliny o 18%. Pacjentów, którzy otrzymują duże dawki teofiliny lub u których z różnych powodów występuje zwiększone ryzyko toksyczności teofiliny, należy obserwować w celu wykrycia objawów toksyczności teofiliny. Jeśli wystąpią takie objawy, leczenie należy odpowiednio zmodyfikować. W przypadku stosowania tofacytynibu z innymi lekami umiarkowanie hamującymi aktywność CYP3A4 i jednocześnie silnie hamującymi aktywność CYP2C19 (np. z flukonazolem), ekspozycja na tofacytynib jest zwiększona. W związku z powyższym zaleca się zmniejszenie dawki tofacytynibu do 5 mg raz na dobę w razie podawania obu leków jednocześnie. W przypadku jednoczesnego stosowania tolwaptanu, substratu CYP3A4, z flukonazolem, umiarkowanym inhibitorem CYP3A4, ekspozycja na tolwaptan jest istotnie zwiększona (200% AUC; 80% Cmax), co wiąże się z ryzykiem znacznego zwiększenia wystąpienia działań niepożądanych, szczególnie znacznej diurezy, odwodnienia i ostrej niewydolności nerek. W przypadku jednoczesnego stosowania, dawka tolwaptanu powinna zostać zmniejszona zgodnie z zaleceniami zawartymi w informacjach dotyczących tolwaptanu, a pacjent powinien być często monitorowany pod kątem wystąpienia jakichkolwiek działań niepożądanych związanych ze stosowaniem tolwaptanu. Mimo braku badań, flukonazol może zwiększać w osoczu stężenia alkaloidów barwinka (np. winkrystyny i winblastyny) i prowadzić do neurotoksyczności, prawdopodobnie w wyniku hamującego działania na CYP3A4. Donoszono o pojedynczym przypadku, w którym u jednego pacjenta otrzymującego leczenie złożone kwasem all-trans-retinowym (kwasowa postać witaminy A) i flukonazolem, wystąpiły działania niepożądane dotyczące OUN, w postaci guzów rzekomych mózgu, które ustępowały po odstawieniu flukonazolu. Powyższe skojarzenie leków może być stosowane, jednak należy brać pod uwagę możliwość występowania działań niepożądanych dotyczących OUN. Jednoczesne podawanie doustnie worykonazolu (400 mg co 12 h przez 1 dobę, następnie 200 mg co 12 h przez 2,5 doby) oraz flukonazolu (400 mg w 1. dniu, następnie 200 mg co 24 h przez 4 doby) u 8 zdrowych mężczyzn powodowało wzrost Cmax oraz AUC worykonazolu o średnio 57% (90% CI: 20%, 107%) oraz 79% (90% CI: 40%, 128%). Nie ustalono dawki i (lub) częstości stosowania worykonazolu i flukonazolu, umożliwiających zmniejszenie powyższego działania. Zaleca się monitorowanie działań niepożądanych związanych z worykonazolem, jeśli jest on stosowany kolejno po flukonazolu. Flukonazol zwiększa Cmax i AUC zydowudyny odpowiednio o 84% i 74%, z powodu zmniejszonego o ok. 45% klirensu zydowudyny podawanej doustnie. Podczas jednoczesnego stosowania z flukonazolem, T0,5 zydowudyny również wydłużał się o ok. 128%. Należy obserwować pacjentów stosujących oba leki jednocześnie w celu wykrycia działań niepożądanych związanych z podawaniem zydowudyny. Należy rozważyć możliwość zmniejszenia dawki zydowudyny. W otwartym, randomizowanym, potrójnie skrzyżowanym badaniu z udziałem 18 zdrowych ochotników, oceniano wpływ azytromycyny, podanej doustnie w pojedynczej dawce 1200 mg, na farmakokinetykę pojedynczej dawki 800 mg flukonazolu, a także wpływ flukonazolu na farmakokinetykę azytromycyny. Nie zaobserwowano istotnych klinicznie interakcji farmakokinetycznych pomiędzy flukonazolem i azytromycyną. Przeprowadzono dwa badania farmakokinetyczne, w których podawano jednocześnie złożone doustne środki antykoncepcyjne i flukonazol w dawkach wielokrotnych. Flukonazol w dawce 50 mg nie miał wpływu na stężenie żadnego z hormonów, natomiast w dawce 200 mg na dobę powodował zwiększenie wartości AUC etynyloestradiolu i lewonorgestrelu odpowiednio o 40% i 24%. Dlatego jest mało prawdopodobne, by flukonazol podawany w wyżej wymienionych dawkach wielokrotnych wywierał wpływ na działanie jednocześnie podawanych doustnych środków antykoncepcyjnych.